Temat:
Odczyn roztworu. Skala pH.
Cele lekcji:
Uczeń wie:
- co to jest odczyn roztworu i od czego zależy;
- kiedy roztwór wykazuje odczyn kwaśny, zasadowy lub obojętny;
- co to jest i od czego zależy skala pH;
- jakie jest praktyczne zastosowanie skali pH.
Uczeń umie:
- zbadać odczyn roztworu za pomocą znanych wskaźników;
- oznaczyć pH roztworu za pomocą uniwersalnego papierka wskaźnikowego;
- określić odczyn roztworu na podstawie jego pH.
Metody dydaktyczne:
- słowna - werbalna;
- doświadczalna - uczniowskie ćwiczenia laboratoryjne.
Środki dydaktyczne:
Probówki, wskaźniki, kwas solny, zasada sodowa, mydło, proszek do prania, ocet, cytryna, mleko, sok z kwaszonych ogórków, sok owocowy, soda.
Przebieg lekcji:
Część nawiązująca:
- przypomnienie definicji kwasów i zasad;
- przypomnienie przebiegu dysocjacji kwasów i zasad;
- przypomnienie co to są wskaźniki, jakie wskaźniki spotykamy w pracowni chemicznej, a jakie można sporządzić w domu;
- jak zmienia się zabarwienie wskaźników w roztworach kwasów i zasad.
Część właściwa:
- Dlaczego dany wskaźnik zmienia zabarwienie w roztworach wszystkich kwasów na taki sam kolor?
W roztworach wodnych kwasów znajdują się kationy wodoru powstałe z dysocjacji:
| np.: |
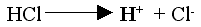 |
Obecność kationów wodorowych decyduje o zmianie barwy wskaźników
w roztworach kwasów.
- Dlaczego w roztworach zasad zabarwienie wskaźnika jest jednakowe?
W roztworach zasad znajdują się jony wodorotlenkowe powstałe z dysocjacji:
| np.: |
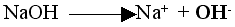 |
i to one determinują zmianę barwy.
- Odczyn jest to cecha roztworu zależna od stężenia jonów wodorowych.
Jeżeli w roztworze stężenie jonów wodorowych jest większe niż stężenie jonów
wodorotlenkowych to roztwór wykazuje odczyn kwaśny.
[H+] > [OH-] odczyn kwaśny
[H+] = [OH-] odczyn obojętny
[H+] < [OH-] odczyn zasadowy
Wskaźniki służą do określania odczynu roztworu:
- fenoloftaleina: bezbarwna w roztworach obojętnych i kwasowych; malinowa
w zasadowych;
- oranż metylowy: pomarańczowy w roztworze obojętnym, czerwony w kwasach,
żółty w zasadach;
- uniwersalny papierek wskaźnikowy: żółty w roztworach obojętnych, czerwony
w kwaśnych, zielononiebieski w zasadach.
Określenie odczynu ma charakter jakościowy, nie informuje jakie jest stężenie
jonów wodorowych.
- Wykładnikiem stężenia jonów wodorowych jest skala zwana pH, cecha określająca kwasowość roztworu. Jest to skala wartości liczbowych od 0 do 14 odpowiadająca stężeniu jonów wodorowych w roztworze.
- Doświadczenie: Badanie pH wybranych roztworów.
Uczniowie badają pH przygotowanych przez siebie roztworów za pomocą uniwersalnego papierka wskaźnikowego i przedstawiają wyniki na przygotowanej skali.
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
| Odczyn kwaśny |
Odczyn obojętny |
Odczyn zasadowy |
- Wykazanie zależności między skalą pH a odczynem roztworu.
- Znaczenie skali pH:
- w medycynie;
- w rolnictwie;
- w ogrodnictwie;
- w hodowli ryb.
Część podsumowująca:
Jaki odczyn mają roztwory jeżeli znajdują się w nich następujące jony:
- Ca2+ i OH-
- Na+ i Cl-
- H+ i NO3-
- H+ i SO4-
Praca domowa:
Odpowiedz na pytania:
Dlaczego pH w ustach spada po każdym posiłku?
Dlaczego regularne mycie zębów zapobiega próchnicy?
Tej samej Autorki:
Scenariusz szkolnego turnieju
ekologicznego "Na ratunek Ziemi"
z okazji Światowego Dnia Ziemi
Grecja - scenariusz przedstawienia na dzień poświęcony Unii Europejskiej.
|